سرگروه آزمایشگاهی اداره نظارت بر تولید و کنترل کیفی تجهیزات پزشکی تاکید کرد:
ضرورت تهیه و تدوین دستورالعمل PMS مرتبط با کیتهای تشخیصی SARS-COV-۲
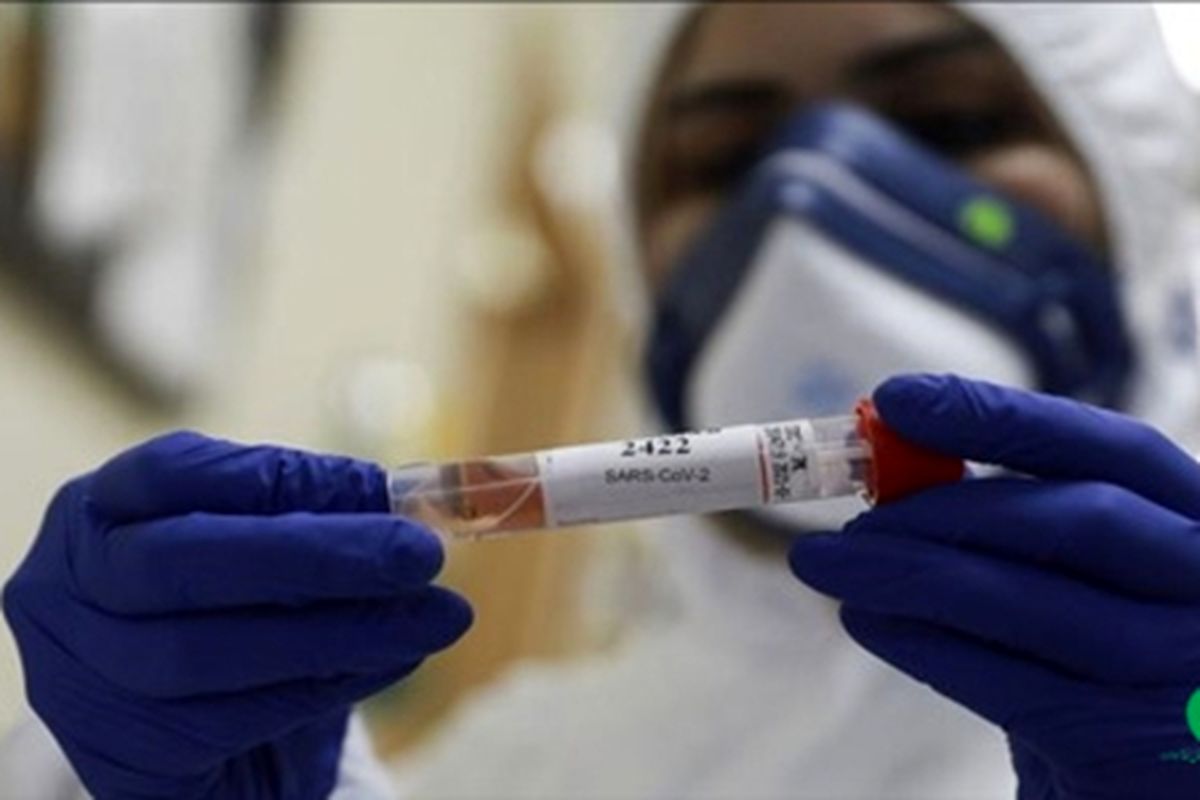
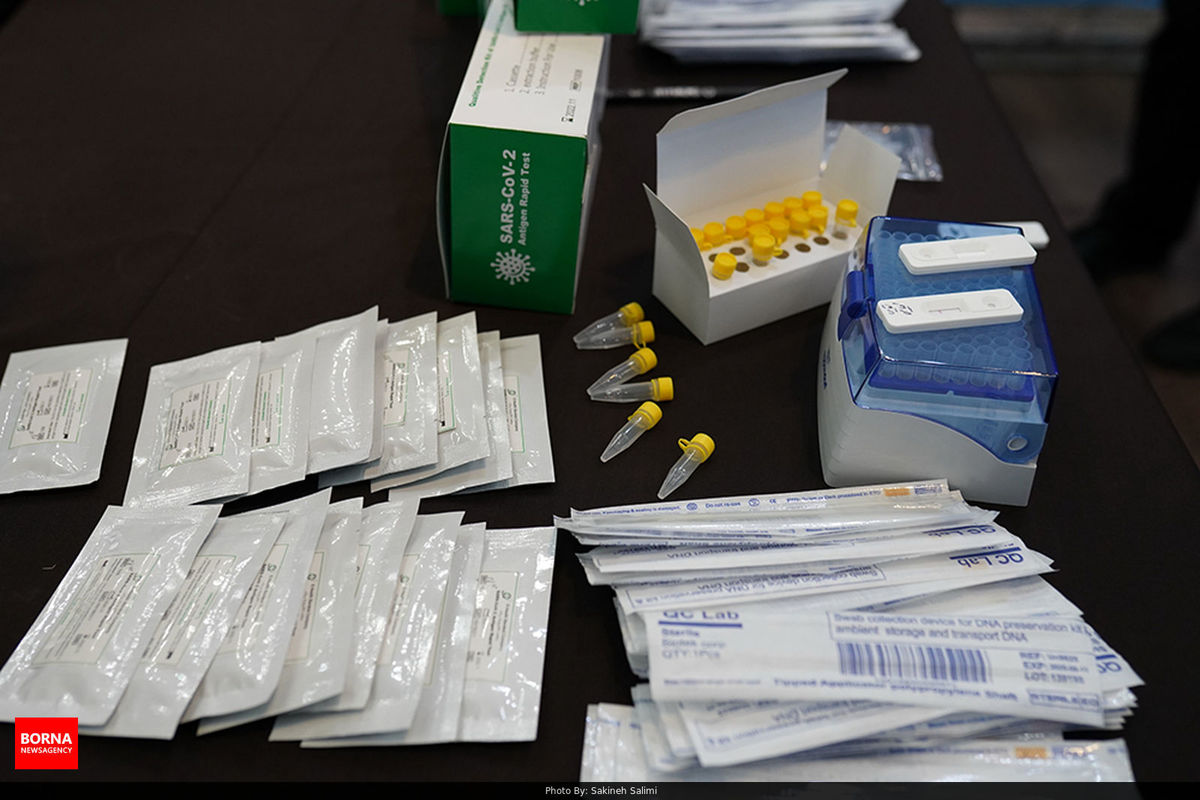
سرگروه آزمایشگاهی اداره نظارت بر تولید و کنترل کیفی تجهیزات پزشکی ضمن تاکید بر ضرورت تهیه و تدوین دستورالعمل PMS مرتبط با کیت های تشخیصی SARS-COV-2، گفت: کلیه شرکت های تولید کننده موظف به تهیه و تدوین دستورالعمل (PMS) Post Market Surveillance و پیاده سازی و اجرای آن جهت نظارت همه جانبه بر محصولات تولید شده هستند.
به گزارش برنا؛ مریم مصباحی، سرگروه آزمایشگاهی اداره نظارت بر تولید و کنترل کیفی تجهیزات پزشکی اداره کل تجهیزات پزشکی، گفت: با عنایت به مجوزهای صادره توسط اداره کل تجهیزات پزشکی و ضرورت پایش مستمر، بررسی و نظارت های پس از صدور مجوز کیت های تشخیصی SARS-COV-2 با برچسب IVD، کلیه شرکت های تولید کننده موظف به تهیه و تدوین دستورالعمل (PMS) Post Market Surveillance و پیاده سازی و اجرای آن جهت نظارت همه جانبه بر محصولات تولید شده هستند.
گفتنی است، کلیه تولید کنندگان این حوزه می بایست تا تاریخ 1400/04/05 نسبت به تکمیل موارد قید شده در جدول پیوست جهت جمع بندی حداقل اسناد مرتبط ( مطابق نامه شماره 480/664 مورخ 1400/03/02) و ارسال آن از طریق سامانه مکاتبات اقدام کنند.
نظر شما
پیشنهاد سردبیر
پرونده ویژه